Neurowissenschaftler*innen können mit modernen MRT-Analysen und statistischen Modellen das sogenannte Brain Age bestimmen – und so verraten, wie gut dein Gehirn dem Lauf der Zeit standhält. Dieser Biomarker könnte nicht nur frühe Anzeichen neurodegenerativer Erkrankungen aufdecken, sondern auch zeigen, wie Lebensstil, Bewegung und mentale Aktivität das Altern im Kopf beeinflussen.
D as Altern des menschlichen Gehirns ist ein komplexer Prozess, der strukturelle, funktionale und molekulare Veränderungen umfasst. In den letzten Jahren hat sich in der Neurowissenschaft das Konzept des Brain Age etabliert: Ein rechnerisch bestimmter Wert, der auf bildgebenden Verfahren und statistischen Modellen basiert. Es beschreibt, ob ein Gehirn im Vergleich zum tatsächlichen, chronologischen Alter jünger oder älter erscheint.
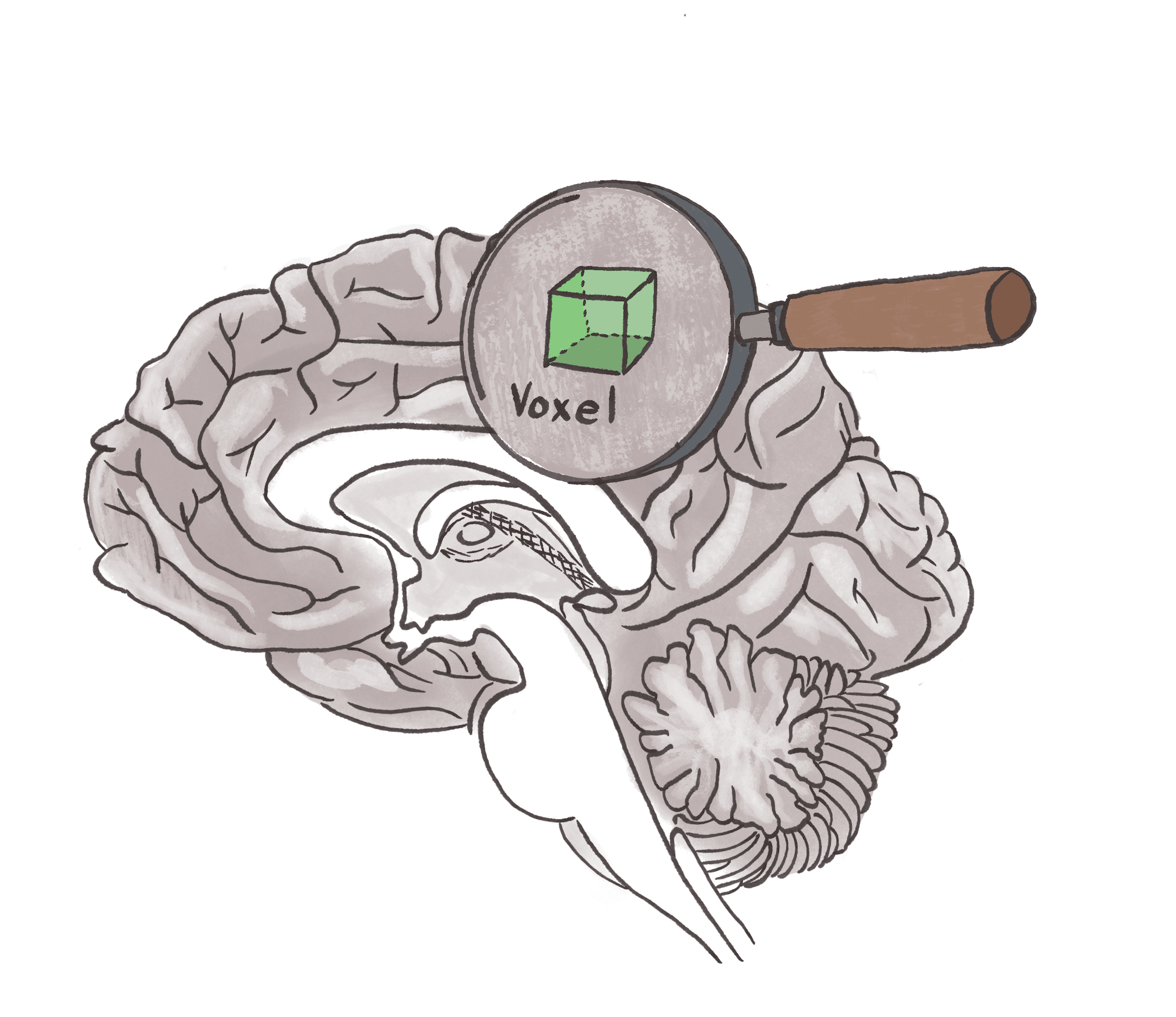
Voxel-based Morphometry (VBM)
VBM ist eine statistische Methode zur Analyse von MRT-Bildern, bei der die Dichte oder das Volumen der grauen und weissen Substanz «voxelweise» verglichen wird. Ein Voxel ist ein volumetrischer Pixel, also die kleinste dreidimensionale Bildeinheit, die im MRT erfasst wird. Das kann man sich als kleines Würfelchen mit Kantenlängen von wenigen Millimetern vorstellen. Nach einer räumlichen Normalisierung, bei der die Gehirne aller Proband*innen auf ein Standardgehirn ausgerichtet werden, können auf diese Weise selbst kleinste strukturelle Unterschiede zwischen Gruppen oder in Bezug auf Variablen wie Alter oder kognitive Leistung detektiert werden. VBM ist zentral für viele Brain-Age-Modelle, da es hochaufgelöste, flächendeckende Informationen über die Gehirnstruktur liefert.
Die Relevanz dieses Konzepts reicht weit über eine reine Altersangabe hinaus. Ein höheres oder niedrigeres Brain Age kann wertvolle Hinweise auf kognitive Reserven, Resilienz und Krankheitsrisiken geben. Damit eröffnet sich ein breites Anwendungsfeld, das von der Grundlagenforschung bis hin zur personalisierten Medizin reicht (Franke et al., 2010; Cole & Franke, 2017).
Die Bestimmung des Brain Age basiert vor allem auf hochaufgelöster struktureller Magnetresonanztomographie (MRT), teilweise ergänzt durch funktionelle MRT oder andere Bildgebungsmodalitäten. Dabei werden zunächst MRT-Bilder des Gehirns aufgenommen, aus denen mithilfe von Verfahren wie der Voxel-based Morphometry (VBM; siehe Box) Unterschiede in Volumen und Dichte von grauer und weisser Substanz ermittelt werden. Anschliessend kommen Machine-Learning-Verfahren zum Einsatz, die auf Grundlage von Datensätzen gesunder Personen mit bekanntem chronologischem Alter trainiert werden. Das so erstellte Modell kann schliesslich für neue Proband*innen das Brain Age schätzen. Die Differenz zwischen vorhergesagtem und tatsächlichem Alter (ΔAge) liefert Hinweise darauf, ob das Gehirn schneller oder langsamer altert als erwartet: Ein positives ΔAge deutet auf ein «älteres» Gehirn hin, ein negatives ΔAge auf ein «jüngeres».
Befunde und klinische Relevanz
Frühe Studien zeigten, dass ein höheres ΔAge mit einem erhöhten Risiko für Demenz und kognitive Beeinträchtigungen assoziiert ist (Cole et al., 2018). Ein «überaltertes» Gehirn kann beispielsweise mit schwächerem Gedächtnis, reduzierter exekutiver Funktion und einer geringeren kognitiven Reserve verbunden sein. Umgekehrt deuten Daten darauf hin, dass ein «jüngeres» Gehirn häufig mit gesünderem Lebensstil, höherer Resilienz und besserer Anpassungsfähigkeit an Hirnpathologien einhergeht.
Interventionsstudien haben gezeigt, dass regelmässige Bewegung, kognitive Stimulation oder Meditation das Brain Age im Schnitt um mehrere Jahre senken können (Luders et al., 2016). In der Praxis bedeutet dies: Veränderungen im Lebensstil lassen sich nicht nur subjektiv spüren, sondern objektiv im Gehirn ablesen – eine Vorstellung, die sowohl für Forschung als auch für Präventionsprogramme hochinteressant ist.
Mechanismen und molekulare Korrelate
Abweichungen im Brain Age spiegeln sich auf zellulärer Ebene in mehreren biologischen Prozessen wider. Dazu zählen eine Abnahme der Myelinintegrität, eine Zunahme chronischer Neuroinflammation und ein Verlust an synaptischer Dichte, die alle in unterschiedlichem Masse zur Alterung des Gehirns beitragen (Peters, 2006). Ergänzend dazu liefern epigenetische Uhren, basierend auf DNA-Methylierungsmustern, unabhängige Biomarker für das biologische Alter (Horvath, 2013).
Entscheidend ist, dass diese Mechanismen nicht isoliert betrachtet werden: Bildgebungsdaten, genetische Profile und Blut-Biomarker können in multimodale Modelle einfliessen, um in Zukunft präzisere und biologisch fundiertere Aussagen zum individuellen Brain Age zu ermöglichen (Cole & Franke, 2017). So liesse sich nicht nur schätzen, wie alt ein Gehirn «wirkt», sondern auch, warum es diesen Zustand erreicht hat.
Anwendungen in Forschung und Praxis
Die Entwicklung und Verfeinerung von Brain-Age-Methoden eröffnet vielfältige Anwendungsmöglichkeiten. Ein erhöhtes Brain Age kann schon vor dem Auftreten klinischer Symptome auf beginnende neurodegenerative Prozesse hinweisen und so Früherkennung und Prävention verbessern (Franke & Gaser, 2019). Ebenso lässt sich das Brain Age nutzen, um den Erfolg von Interventionen zu messen – von medikamentösen Therapien über kognitives Training bis hin zu gezielten Lebensstiländerungen.
In der personalisierten Medizin ermöglicht die Quantifizierung des neuronalen Alters eine differenzierte Anpassung von Risikoprofilen und Behandlungsstrategien. Für Psychologiestudierende ist dies nicht nur ein Beispiel für den Transfer von Forschung in die Praxis, sondern auch ein Einblick in die Schnittstelle von Neurowissenschaft, Technologie und individueller Gesundheitsförderung.
Kritische Betrachtung
Trotz seines Potenzials steht das Konzept vor wichtigen Herausforderungen. Unterschiede in MRT-Scannern und Aufnahmeprotokollen können zu systematischen Verzerrungen führen (Pomponio et al., 2020). Ebenso kann der sogenannte Population Bias dazu führen, dass Modelle für Bevölkerungsgruppen, die in Trainingsdatensätzen unterrepräsentiert sind, weniger genau arbeiten. Diese methodischen Hürden haben nicht nur statistische, sondern auch ethische Relevanz: Wird ein Modell klinisch angewandt, könnten Fehleinschätzungen reale Konsequenzen für Diagnosen oder Therapieentscheidungen haben.
Zudem ist Brain Age ein globaler Marker, der zwar Abweichungen vom erwarteten Alter aufzeigt, aber keine detaillierten Aussagen über spezifische Pathologien zulässt. Um dieses Defizit zu beheben, muss die Forschung die Verbindung zwischen molekularen Mechanismen und bildgebenden Befunden weiter präzisieren.
Fazit
Brain Age ist ein innovativer Biomarker, der Einblicke in biologische Alterungsprozesse des Gehirns bietet. Er eröffnet neue Möglichkeiten zur Früherkennung, Prävention und Therapie, und ist damit sowohl für die Grundlagen- als auch die angewandte Forschung hochrelevant. Für Psychologiestudierende bietet das Thema Brain Age einen faszinierenden Einblick in die Schnittstelle von Neurowissenschaft, datengetriebener Forschung und klinischer Anwendung.